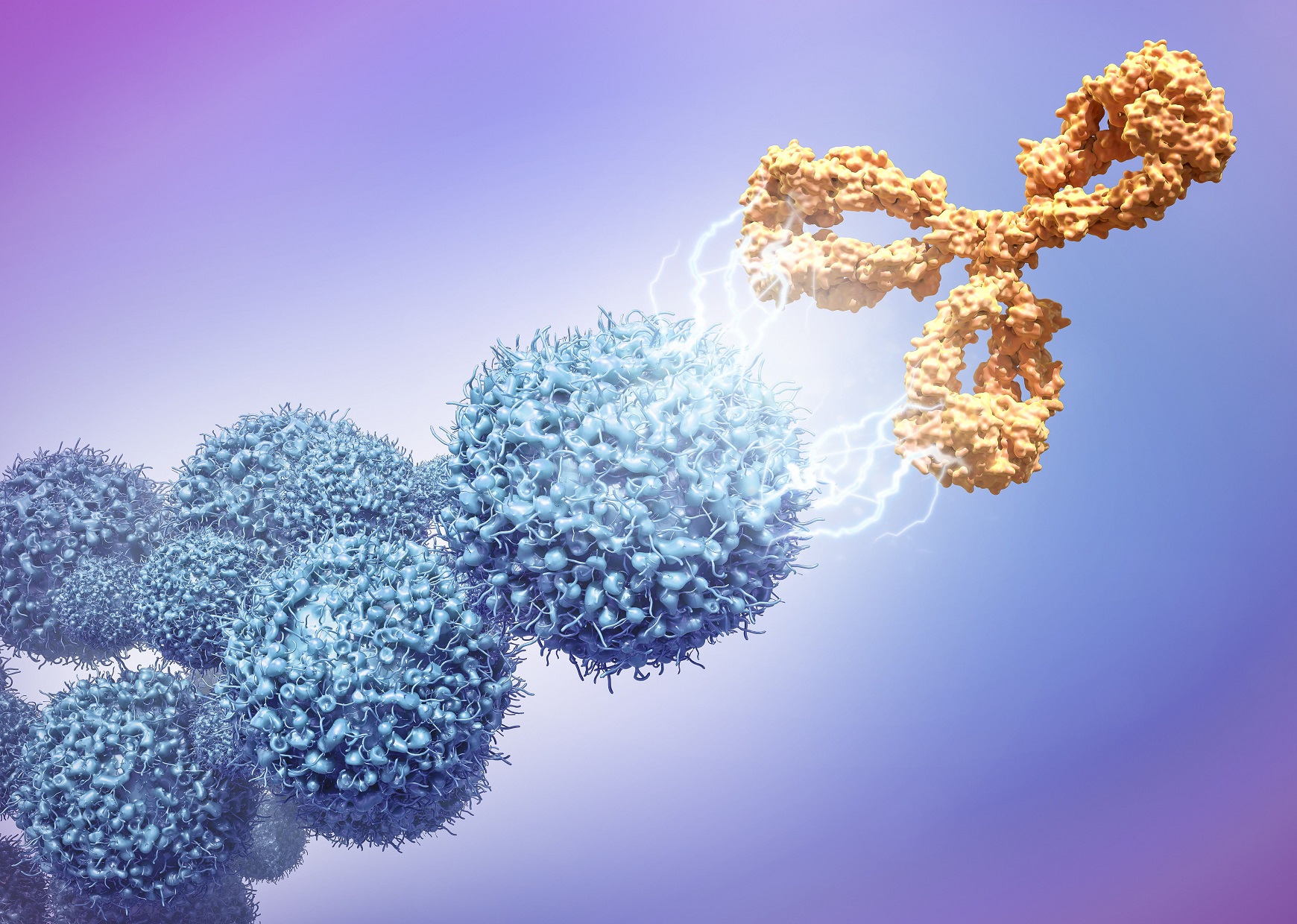
Моноклональные антитела — класс препаратов, обладающих высокой избирательностью в отношении мишени на молекулярном уровне, которая является одним из ключевых звеньев заболевания. Антитела умеют точно связываться с антигеном благодаря специальным антигенсвязывающим участкам, имеющим к нему высокую селективность. Для лекарств на основе антител это определяет их специфичность в отношении конкретной мишени.
Другими словами, сегодня моноклональные антитела - это волшебные пули, о которых мечтал Пауль Эрлих в начале ХХ века
Более ста лет назад легендарный немецкий ученый поставил перед собой фантастическую и недостижимую по тем временам задачу — смоделировать соединение, смертельное для болезнетворного микроорганизма, но в то же время безопасное для человека.
История открытия таргетной терапии
В начале 70-х годов один немецкий иммунолог, по имени Жорж Кёлер, получил стипендию для работы в Basel Institute for Immunology. Его заинтересовал вопрос о генетической изменчивости антител. Можно было ожидать, что антитела генетически изменяются (мутируют) с бóльшей частотой, чем другие протеины. Для исследования надо было изолировать клон АОК (антителообразующие клетки), продуцирующие антитела определенной специфичности, получить из клона стабильную клеточную линию, поддерживаемую в пробирке и проследить частоту проявления генетически измененных вариантов.
Для реализации проекта Кёлер отправился в Англию, лабораторию Сезара Мильштейна, изучавшего клоны плазмоцитом. И вместе, они разработали оригинальный подход к этой проблеме: получить гибрид нормальной АОК и опухолевой клетки.
В результате длительной работы такой гибрид унаследовал от нормальной клетки способность к синтезу антител, а от опухолевой — бессмертие и способность к неограниченному и бесконтрольному росту.
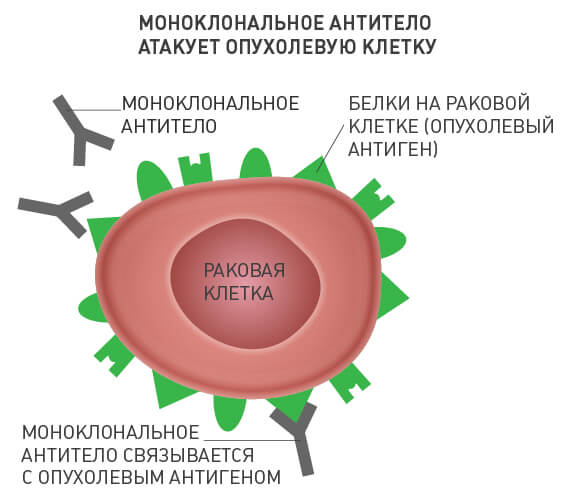
Что такое моноклональные антитела
Антитела — это молекулы, продуцируемые клетками иммунной системы. Они способны не только распознавать антигены — структуры, чуждые для нашего организма, — но помогают в атаке и уничтожении последних.
Каждое антитело узнает только свой антиген (его детерминантную группу). В одном белке, состоящем из нескольких сотен аминокислот, есть от 5 до 15 различных детерминант, поэтому к 1 белку образуется целое семейство различных по своей специфичности антител.
При введении антигена возникает большое семейство антител, направленных к разным его детерминантам и различающихся также внутри группы антител, направленных к одной и той же детерминанте. В крови иммунизированных животных появляется богатый и уникальный по составу спектр антител, который и обеспечивает их абсолютную специфичность в распознавании данного антигена.
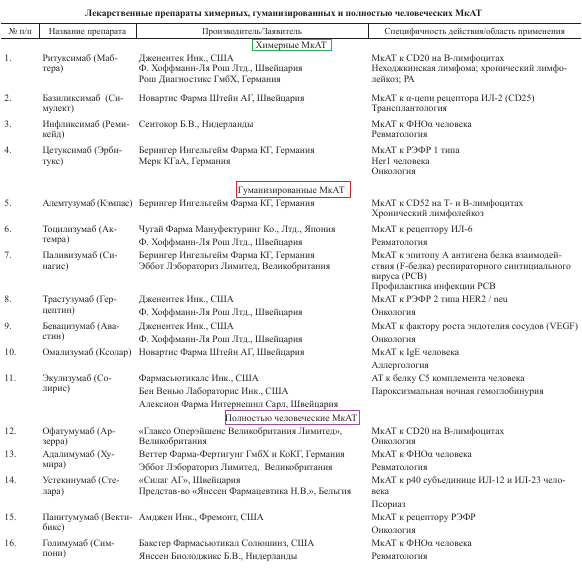
Классификация моноклональных антител
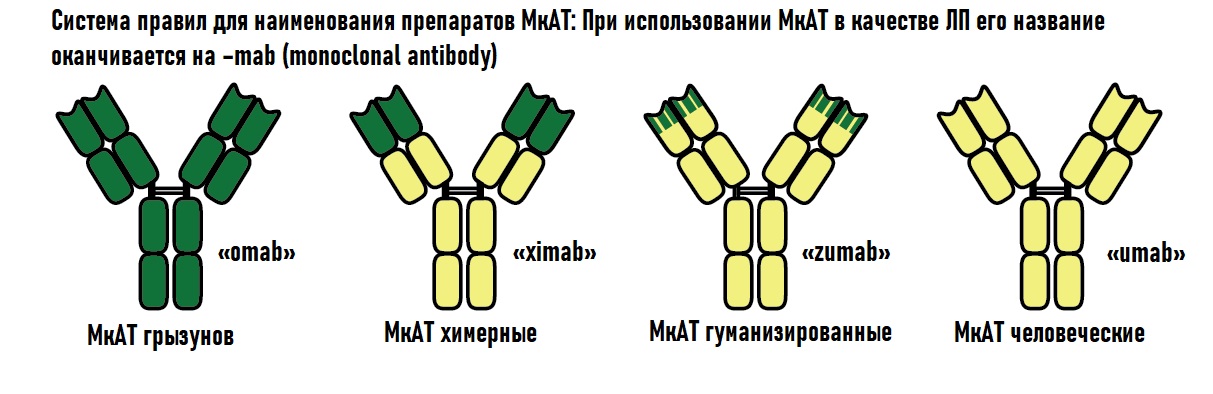 Эти антитела работают за пределами клетки. Антитело связывается со специфическим сайтом и блокирует процессы в клетке, приводящие к патологиям в органах и тканях.
Эти антитела работают за пределами клетки. Антитело связывается со специфическим сайтом и блокирует процессы в клетке, приводящие к патологиям в органах и тканях.
Это более точная и безопасная стратегия, чем у традиционных препаратов. МкАТ как лекарства имеют множество областей для применения. Это не только блокирование сайтов связывания, но и доставка радионуклидных препаратов точно в цель.
Области применения МкАТ
- Диагностика вирусов, бактерий и паразитов;
- Определение растворимых АГ, в т.ч. для клинической диагностики;
- Диагностика поверхностных АГ клеток, в частности CD-АГ;
- Выделение высокоочищенных белков методом аффинной хроматографии;
- Определение беременности;
- Терапия различных заболеваний.
Показания для препаратов МкАТ
- Онкология – 80% (онкогематология и солидные опухоли);
- Аутоиммунные заболевания;
- Аллергические и инфекционные заболевания;
- Сердечно-сосудистые заболевания;
- Трансплантология.
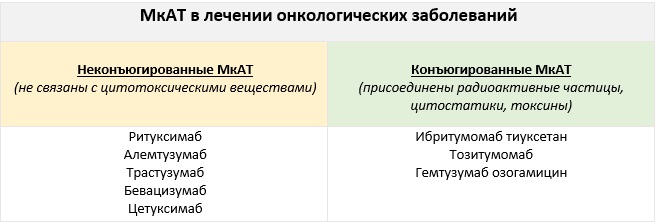
МкАТ в лечении онкологических заболеваний.
Аллергические реакция (системные и местные);Основные побочные эффекты препаратов МкАТ
- Гематотоксичность и угнетение кроветворения;
- Инфекционные осложнения (туберкулез, герпес, пневмонии др. заболевания дыхательных путей);
- Нарушения в системе свертывания крови;
- Неэффективность терапии (необходимо найти «свой» препарат).
Безопасность препаратов моноклональных антител
Как и другие лекарства, моноклональные препараты не являются панацеей и способны так же вызывать серьезные побочные эффекты.Что интересно, развитие побочных эффектов напрямую связано и с природой самого лекарства
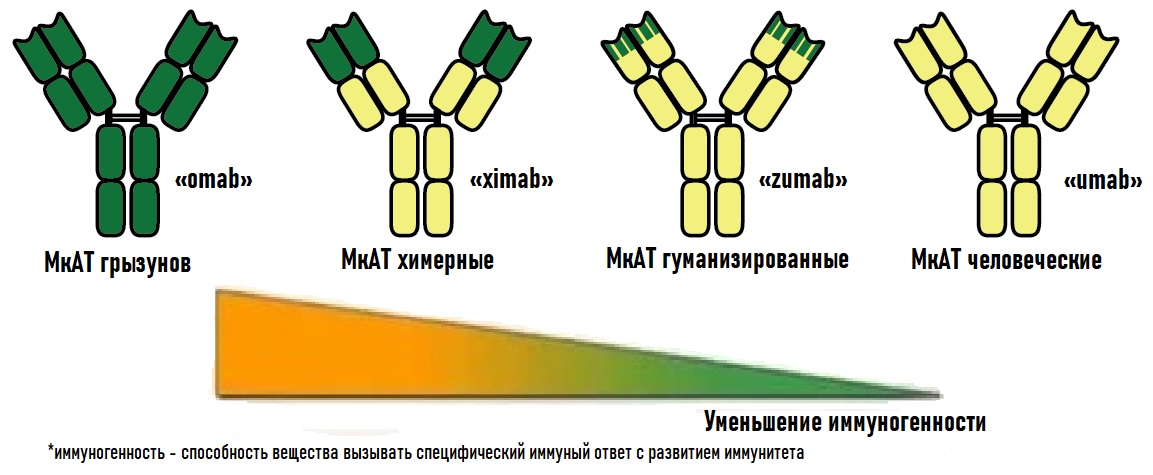
рассмотрим подробнее
- В 2010 году FDA (Food and Drug Administration) были получены сведения о 30 случаях развития раковых заболеваний у детей, принимавших препараты моноклональных антител - Хумира и Ремикейд (лимфомы, лейкемия, меланомы).
- Результаты мета-анализа, опубликованные в Journal of Clinical Oncology (2011), показали, что прием Avastin увеличивает риск остановки сердца, причем независимо от принятой дозы. Смертельные случаи сопровождались обширными геморрагиями, нейтропенией, перфорациями ЖКТ.
- В июле 2006 года предупреждение о развитиии ПМЛ (Прогрессивная мультифокальная лейкоэнцефалопатия) включено в инструкцию по применению препарата Тизабри.
- В январе 2010 г. выявлен 31 случай ПМЛ. FDA не запретило использование препарата, поскольку его клинический эффект превышает риски. В Европейском союзе препарат разрешен только для лечения рассеянного склероза в виде монотерапии.
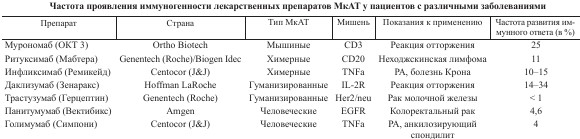
По состоянию на 31 октября 2016 года на рынках Европы и США существует уже семьдесят один препарат на основе МкАТ. В 2010 году одобрили 10 новых препаратов для использования на территориях США и Европы. По состоянию на 1 декабря 2017 года девять терапевтических МкАТ проходят регуляционные тестирования. Также в конце 2018 года отправлены заявки на получение торговой лицензии 12 новых препаратов, из которых 4 предназначены для лечения онкологических заболеваний.
Литература
- Jasanoff S. Designs on nature: science and democracy in Europe and the United States. Princeton University Press, 2011. — 392 p.;
- Кеннет Р.Г., Мак-Керн Т. Дж., Бехтол К.Б. Моноклональные антитела. Гибридомы: новый уровень биологического анализа. М.: Медицина, 1983. — 416 с.;
- John McCafferty, Andrew D. Griffiths, Greg Winter, David J. Chiswell. (1990). Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 348, 552-554;
- Kim Newton, Marissa L. Matsumoto, Ingrid E. Wertz, Donald S. Kirkpatrick, Jennie R. Lill, et. al.. (2008). Ubiquitin Chain Editing Revealed by Polyubiquitin Linkage-Specific Antibodies. Cell. 134, 668-678.
- Альтшулер Е., Серебряная Д., Катруха А. (2010). Получение рекомбинантных антител и способы увеличения их аффинности. Успехи биологической химии. 50, 203.
- Zielinska E. (2013). Side-chain theory, circa 1900. The Scientist;
- N. K. Jerne. (1955). THE NATURAL-SELECTION THEORY OF ANTIBODY FORMATION. Proceedings of the National Academy of Sciences. 41, 849-857;
- F. M. Burnet. (1976). A Modification of Jerne's Theory of Antibody Production using the Concept of Clonal Selection. CA: A Cancer Journal for Clinicians. 26, 119-121;
- Cosimi A.B. (1987). Clinical development of Orthoclone OKT3. Transplant. Proc. 19, 7–16;
- Dotan E., Aggarwal C., Smith M.R. (2010). Impact of Rituximab (Rituxan) on the treatment of B-cell non-Hodgkin's lymphoma. P. T. 35, 148–157;